工藝特異型宿主細胞蛋白(HCP)殘留檢測高風險蛋白
來源:
發布時間:2025-08-21
宿主細胞蛋白(HCP)作為生物制品中來源于細胞基質的殘留雜質,具有明顯的異質性特征。其復雜性體現在三個方面:①理化特性差異:HCP涵蓋胞內及分泌蛋白,涉及關鍵生理功能,具有涵蓋區間大的等電點(pI 3-11)、分子量范圍(5-250kDa)及疏水性;②上游工藝影響:不同發酵工藝(如細胞株、培養條件)誘導獨特的翻譯后修飾(PTM),導致HCP總量與生化復雜性增加;③下游工藝與產物特性干擾:抗體、細胞因子等重組蛋白或病毒類藥物的純化工藝會選擇性殘留特定HCP,且產物形式(如大腸桿菌的包涵體/可溶性表達)直接影響HCP殘留譜。針對特定生產工藝開發定制化檢測方案是準確監控宿主細胞蛋白殘留的關鍵。
湖州申科系列HCP檢測產品均進行了校準品的表征分析,抗體覆蓋率分析。工藝特異型宿主細胞蛋白(HCP)殘留檢測高風險蛋白
磷脂酶B樣蛋白2(Phospholipase B-Like 2,PLBL2/PLBD2),因其強共純化能力、強免疫原性和潛在的酶活性,被認為是CHO HCP的關鍵高風險因子之一。目前行業建議,需要開發特定的檢測方法對這些已知蛋白或特定蛋白進行監控以更好地把控其潛在風險。SHENTEK® CHO PLBL-2殘留檢測試劑盒(酶聯免疫吸附法)是湖州申科生物自主研發的、具有完全自主知識產權的CHO PLBL-2蛋白通用檢測試劑盒。本試劑盒適用于基于CHO表達系統的生物制品中CHO HCP高風險蛋白PLBL-2的定量檢測。本試劑盒操作步驟少,快速,檢測專一性強,性能穩定可靠。
北京單抗藥物用宿主細胞蛋白(HCP)殘留檢測常見問題分析不同 HCP 試劑盒檢測結果有差異,企業要評估篩選合適方案。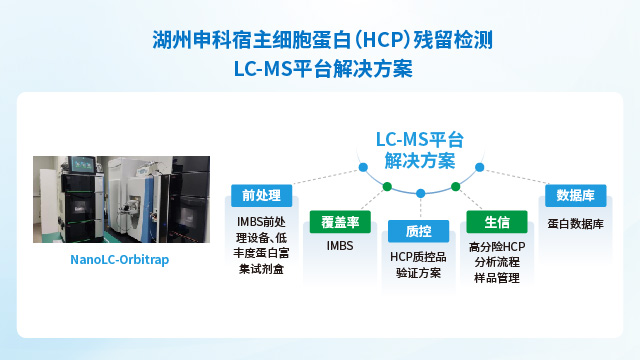
各國法規要求必須對生物藥品進行分析和純化,以將宿主細胞蛋白HCP降低到可接受的水平;即使終產品中痕量的宿主細胞蛋白HCP到達患者體內,尚不清楚特定的殘留蛋白質雜質是否會影響藥物的穩定性或免疫原性。關于HCP的限量標準,美國藥典推薦值為終產品的HCP水平1-100 ng/mg;中國藥典各論中E.coli菌體HCP應不高于蛋白質總量的0.10% (1000 ng/mg),CHO細胞HCP應不高于蛋白質總量的0.05% (500 ng/mg),假單胞菌HCP應不高于蛋白質總量的0.02% (200 ng/mg)。
湖州申科生物依托高分辨質譜技術推出宿主細胞蛋白定制化檢測服務組合,覆蓋生物制品殘留蛋白分析需求。該平臺提供四類服務:HCP蛋白檢測定制化服務;通過ELISA、雙向電泳(2D)及LC-MS/MS技術,支持常規生物制品檢測、高危及工藝相關蛋白數據庫構建以及特殊生物制品分析;抗體覆蓋率服務采用自主研發的IMBS技術結合質譜,準確評估ELISA試劑盒對工程細胞HCP的捕獲能力,并完成校準品表征;靶向HCP檢測專注于高風險殘留蛋白的方法開發;同時提供蛋白種屬鑒定服務,利用LC-MS技術溯源樣品中的物種特異性肽段。該服務體系通過多技術聯用與深度定制化策略,滿足從基礎篩查到工藝關鍵雜質監控的全維度需求。
宿主細胞蛋白殘留檢測試劑盒的開發不是一個簡單的過程,是一個對平臺、技術均有很高要求的整體流程。
為什么定制化試劑盒是宿主細胞蛋白殘留檢測的優先選擇?原因之一是建立定制化檢測體系,更滿足商業化生產HCP工藝雜質控制要求。在HCP校準品和HCP抗體兩大關鍵試劑組分滿足要求的前提下,定制化方法的建立和優化是基于真實純化中間品和原液樣品進行,通過優化檢測條件,提高對低濃度HCPs的檢測靈敏度,滿足工藝驗證和過程控制要求。在臨床三期,生產工藝需要進行系統驗證,以確保其穩定性和可重復性。定制化HCP ELISA檢測方法能夠更準確地監測生產工藝中HCP的去除效果,為工藝驗證提供有力支持。在過程控制中,通過工藝特異型的HCP ELISA檢測方法,可以實時監測生產過程中的HCP水平,具備更強的生產異常預警能力,及時發現生產風險,確保產品質量的穩定性。
HCP 定制化開發需構建成熟平臺、技術實力、合規體系、穩定供應、專業團隊及成功案例的全維度支撐體系。江蘇工藝特異型宿主細胞蛋白(HCP)殘留檢測方法開發湖州申科搭建高分辨蛋白質譜技術平臺,結合IMBS技術,推出了IMBS-MS抗體覆蓋率評估方法。工藝特異型宿主細胞蛋白(HCP)殘留檢測高風險蛋白
湖州申科生物致力于提供符合嚴格法規要求的宿主細胞蛋白(HCP)ELISA檢測試劑盒。為確保產品滿足生物制品(如抗體藥、疫苗)申報(如IND/BLA)的監管標準,申科構建了全流程依規開發的質量體系:整個開發過程嚴格遵循ISO 13485質量標準,并滿足用戶審計要求。其開發流程明確包含三個關鍵階段:①HCP殘留定量檢測參考品開發:關鍵在于建立可靠的HCP抗原參考品,涵蓋抗原的表征、量值溯源與賦值、均一性和穩定性考察等,確保檢測的準確性與代表性。②高質量大批量抗體制備:通過優化的HCP抗原動物免疫策略,結合嚴謹的抗體質量標準(如建立標準、覆蓋率驗證)和穩定的制備工藝,生產具有高特異性和廣覆蓋度的檢測抗體,保證檢測的特異性和靈敏度。③檢測體系開發及驗證:進行嚴謹的檢測體系開發與驗證工作,其驗證方案符合ICH指導原則及藥典關于分析方法驗證的標準要求。同時,嚴格執行物料質控,并在潔凈車間環境中進行生產,確保試劑盒方法的穩健性、重現性與法規符合性。這一從抗原源頭到成品體系的標準化、合規化開發流程,是湖州申科HCP檢測產品品質與可靠性的根本保障。
工藝特異型宿主細胞蛋白(HCP)殘留檢測高風險蛋白
相關新聞
- 安徽宿主細胞殘留DNA檢測生產企業 2025-09-18
- 天津Vero宿主細胞殘留DNA檢測常用知識 2025-09-18
- 廣東MDCK宿主細胞殘留DNA檢測常見問題 2025-09-18
- 江西CHO宿主細胞殘留DNA檢測方案 2025-09-18
- 抗體藥物宿主細胞殘留DNA檢測標準 2025-09-18
- 重慶MDCK宿主細胞殘留DNA檢測生產企業 2025-09-18
- 浙江重組蛋白用宿主細胞蛋白(HCP)殘留檢測 2025-09-17
- 浙江生物制品宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-09-17
- HEK293宿主細胞殘留DNA檢測定量參考品 2025-09-17
- 陜西E.coli宿主細胞殘留DNA檢測常用知識 2025-09-17
推薦新聞
- 四川4K手術直播會診歡迎選購 2025-09-22
- 黑龍江國產透明質酸酶答疑解惑 2025-09-22
- 壓阻式平衡測試系統產品 2025-09-22
- 山西本地電動手術臺功效 2025-09-22
- 投標脊柱評估系統多少錢 2025-09-22
- 四川高光合多通道冠層光合儀 2025-09-22
- 江西家用缺血預適應訓練儀功能 2025-09-22
- 長寧區比較好的易型EMA服務電話 2025-09-22
- 靜安區葉綠素熒光成像系統牌子 2025-09-22
- 浦東新區有什么聚醚醚酮 2025-09-22