上海疫苗產品用宿主細胞蛋白(HCP)殘留檢測
來源:
發布時間:2025-09-01
湖州申科生物建立了專業化宿主細胞蛋白殘留檢測平臺,利用 ELISA 方法分析宿主細胞蛋白總量,嚴格把控CV差異和回收率結果,保證實驗結果真實性,開發的試劑盒或抗體具有靈敏度高、特異性強等特點。在技術服務方面,平臺提供兩類關鍵支撐:一是覆蓋多種宿主(包括CHO、E.coli,酵母等)的殘留HCP檢測服務,直接輸出蛋白殘留量及樣品回收率數據;二是配套的樣品適用性驗證體系,通過基質定量下限驗證、樣品稀釋度驗證、準確性驗證及精密度驗證(含重復性與中間精密度)等多維度檢測方案,結合完整的試劑盒性能報告,確保檢測結果的準確性與可溯源性,為生物制品工藝雜質控制提供可靠保障。
抗體覆蓋率評估屬于定性分析,要求是穩定性好,靈敏度高,與ELISA檢測的原理相似,確保結果準確可靠。上海疫苗產品用宿主細胞蛋白(HCP)殘留檢測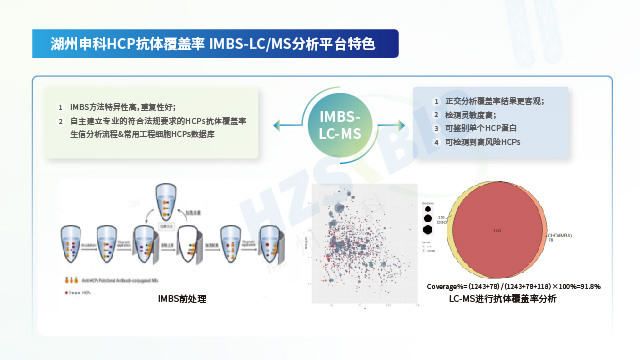
LC-MS技術作為生物制品宿主細胞蛋白殘留檢測新趨勢,需考慮以下幾點:①穩定性:需要HCPs LC-MS檢測流程進行驗證,全流程都需要有嚴格的QC控制,確保檢測結果的一致性和穩定性。②可重復性:不同類型生物制品中HCPs提取效率不同,不同人員操作存在差異,需要在上機前通過不同方法評估HCPs的提取效率,避免人為因素造成結果重復性差。③準確度:方法開發與驗證階段,通過設立內標與定量算法,根據內標響應回算得到HCPs的含量,確保定量結果的準確性。④抗干擾能力:高豐度蛋白和特殊基質會對質譜檢測產生影響,需要通過前處理手段對高豐度蛋白或特殊的基質進行去除,以減少其對HCPs肽段在質譜檢測時的影響。⑤真實性:樣品中除HCPs以外的物質在質譜分析中同樣會產生質譜信號,需要去除復雜的背景噪音避免假陽性和假陰性的出現,建立合理標準的生信分析流程。分析流程建立過程中同樣需要建立嚴格的質控QC標準,并通過后期不同方法進行驗證,確定其標準的真實性。
廣東MDCK宿主細胞蛋白(HCP)殘留檢測平臺型試劑盒適用于相近工藝產品線,可適用監測不同產品 HCP 水平。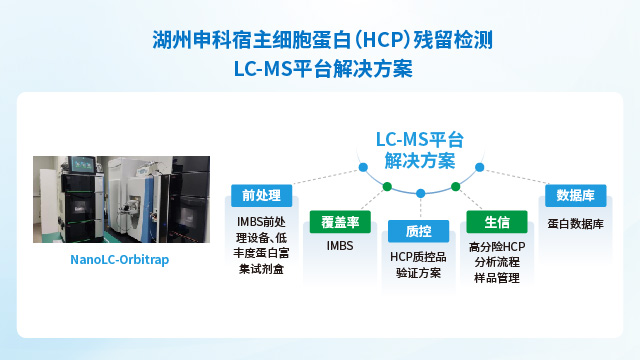
大腸埃希氏菌(Escherichia coli,E. coli)又稱大腸桿菌,其作為模式微生物被廣泛應用于生命科學研究中。隨著基因治療產業的大力發展,大腸桿菌也被主要應用于質粒DNA(pDNA)的生產。由于質粒樣品的常見提取工藝中往往使用條件劇烈的堿溶液進行細胞裂解和蛋白質變性,使得其中的HCPs與傳統物理破碎法獲得的HCPs有較大的差異,導致其在采用免疫學原理的檢測方法時,殘留檢測結果差別較大。湖州申科生物E.coli克隆菌堿裂HCP殘留檢測試劑盒用于大腸桿菌(又名大腸埃希菌)克隆菌株相關的HCPs檢測,如DH5α、Top10、JM109等。在抗體制備時采用堿裂工藝制備的HCPs免疫動物,獲得專門的抗體。適用于經堿液裂解工藝處理后的宿主細胞蛋白HCPs定量檢測。
湖州申科生物憑借其先進的整合技術平臺在HCP檢測領域建立起優勢。公司通過自主研發突破性技術—包括基于IMBS的抗體覆蓋率檢測方法和基于核酸文庫的低豐度HCP富集技術,提升了HCP檢測的靈敏度和HCP抗體覆蓋能力,相關成果已發表于《中國新藥雜志》《藥物分析雜志》等期刊并納入國家科技重大專項。同時,依托前沿的精密分析平臺,湖州申科構建了覆蓋完整HCP分析鏈條的LC-MS解決方案,涵蓋抗原一致性評價、IMBS前處理、低豐度蛋白富集、生信分析及專屬數據庫構建等關鍵環節,形成從樣品管理到風險分析的閉環體系。該平臺嚴格依照法規要求,所有檢測技術均通過符合ICH及藥典要求的方法學驗證,確保數據可靠并滿足生物制品申報(如IND/BLA)的法規標準。憑借這一技術整合能力,公司已為全球200余家生物醫藥企業提供從工藝開發到質控放行的一站式HCP檢測服務,賦能單抗、疫苗等產品的安全性與合規性提升。
工藝特異型、平臺型、通用型HCP檢測試劑盒各有特點,滿足不同需求。
影響宿主細胞蛋白(HCP)殘留檢測結果的因素之一是方法選擇。酶聯免疫吸附法(ELISA法)和液相色譜-質譜聯用方法(LC-MS法)是目前HCP檢測的兩大常用方法。文獻統計顯示,目前對于總HCP定量,ELISA仍是主流方法;MS法作為對特定蛋白(例如,高風險蛋白)的鑒定和定量,已成為重要的互補手段。此外檢測過程中使用的試劑和耗材的質量直接影響檢測結果的準確性。低質量的試劑可能導致假陽性或假陰性結果。例如,抗體的特異性和親和力不足,可能導致ELISA檢測中的交叉反應;抗原代表性不強或是抗體覆蓋率低,可能會導致漏檢;稀釋液抗干擾能力弱,可能影響檢測準確性。案例研究表明,采用定制化方法替代原有商業化試劑盒后,抗原代表性和抗體覆蓋率明顯提高,HCP檢測值整體升高。
深入分析宿主細胞蛋白殘留檢測的數據,能為生產工藝的優化調整提供明確方向。MRC-5宿主細胞蛋白(HCP)殘留檢測方法開發湖州申科自主開發的抗體覆蓋率驗證IMBS平臺經完善驗證,結果可靠,符合法規要求,可用于申報。上海疫苗產品用宿主細胞蛋白(HCP)殘留檢測
按照美國藥典1132章節的要求,HCPs校準品需滿足代表性要求,即能覆蓋實際工藝產品生產中的HCPs。從HCP免疫檢測方法使用目的和預期風險管理要求考慮,滿足工藝開發和驗證,同時為了應對下游工藝中潛在的異常工藝失效,或工藝變更需求,建議采用上游發酵工藝末端,如澄清處理后工藝點的樣本作為HCPs的來源。在實際制備中,可采用空細胞或空載細胞在模擬實際工藝的預定條件進行采集,通過二維電泳或高分辨率質譜等蛋白質組學方法進行模擬工藝和實際工藝下HCPs的代表性表征分析。越靠近下游HCPs蛋白種類越少,也越接近DS中HCPs,但是其可能無法滿足工藝開發和驗證需求,也無法保證工藝的潛在風險,往往不推薦使用,或只作為上游工藝HCPs免疫檢測法的輔助使用。
上海疫苗產品用宿主細胞蛋白(HCP)殘留檢測
相關新聞
- 安徽宿主細胞殘留DNA檢測生產企業 2025-09-18
- 天津Vero宿主細胞殘留DNA檢測常用知識 2025-09-18
- 廣東MDCK宿主細胞殘留DNA檢測常見問題 2025-09-18
- 江西CHO宿主細胞殘留DNA檢測方案 2025-09-18
- 抗體藥物宿主細胞殘留DNA檢測標準 2025-09-18
- 重慶MDCK宿主細胞殘留DNA檢測生產企業 2025-09-18
- 浙江重組蛋白用宿主細胞蛋白(HCP)殘留檢測 2025-09-17
- 浙江生物制品宿主細胞蛋白(HCP)殘留檢測方法學驗證 2025-09-17
- HEK293宿主細胞殘留DNA檢測定量參考品 2025-09-17
- 陜西E.coli宿主細胞殘留DNA檢測常用知識 2025-09-17
推薦新聞
- 長寧區附近教育軟件服務電話 2025-09-20
- 虹口區新款醫療管理服務服務費 2025-09-20
- 四川全腸道菌群檢測制劑 2025-09-20
- 福建真空成型片廠家 2025-09-20
- 上海高韌性尼龍有哪些 2025-09-20
- 支原體 IgG ELISA 試劑盒 2025-09-20
- 重慶質量醫用吊塔批發價 2025-09-20
- 江蘇臨床前藥物遺傳毒性試驗服務檢測中心 2025-09-20
- 廣東綠色環保通用試劑 2025-09-20
- 風車形無影燈一站式采購 2025-09-20